Uma patente concedida no Brasil protege uma tecnologia por vinte anos contados a partir da data de depósito do pedido no Instituto Nacional da Propriedade Industrial (INPI). Quando termina esse prazo de vinte anos de proteção, aquela matéria entra em domínio público, podendo ser produzida e comercializada por indústrias concorrentes. A concorrência reduz os preços ao consumidor, reduz o gasto do SUS com as compras públicas e induz ao desenvolvimento de novas inovações para novos tratamentos, ampliando o acesso.
Na prática, porém, não é bem assim que acontece. Um produto pode ser protegido por diversas patentes. Isso porque cada patente concedida irá proteger determinado aspecto de um produto. Por exemplo, há patentes de molécula, de composições, de processos industriais, de dispositivos, novas formas farmacêuticas e até de segundo uso médico de uma molécula já conhecida.
Além disso, um aspecto pouco debatido é a exclusão da anuência prévia da Agência Nacional de Vigilância Sanitária (Anvisa) nos pedidos de patente após a reforma da legislação. Com isso, o Ministério da Saúde deixou de atuar como protagonista nas questões de propriedade intelectual de medicamentos estratégicos. Essa lacuna abre espaço para concessões de patentes com baixa contribuição inventiva, muitas vezes utilizadas apenas como estratégias para prolongar artificialmente o monopólio de mercado, uma estratégia chamada de “evergreening”. Caberia ao Estado, portanto, estabelecer mecanismos para oferecer subsídios técnicos ao INPI e evitar a concessão de patente para pedidos infundados ou excessivos.
Existem alguns programas de exame prioritário de pedidos de patentes no INPI, como o de Tecnologia para Tratamento de Saúde e de Tecnologia para Tratamento de Covid, porém eles não substituem a contento o antigo programa prioritário de produtos e processos farmacêuticos relacionados à saúde pública, em particular aqueles considerados estratégicos no âmbito do SUS, estipulado na Resolução PR nº 80/2013, que foi revogada.
Quando a concorrência analisa as possibilidades de lançamento de um produto de interesse, todo esse bloco de patentes do produto deve ser analisado a fim de não infringir patentes de terceiros que ainda estejam protegendo partes da tecnologia. Às vezes, uma mesma molécula pode estar envolvida na proteção de mais de um produto.
Por exemplo, a tão falada semaglutida. Ela está presente nos medicamentos Ozempic, Rybelsus e Wegovy, todos de titularidade da Novo Nordisk. O medicamento Ozempic, administrado na forma de injeção subcutânea semanal e indicado para diabetes tipo 2, foi o primeiro produto da empresa titular a ter patente concedida e irá expirar em 2026. O Rybelsus, também indicado para tratamento de diabetes, mas administrado na forma de comprimidos orais diários, possui proteção patentária até 2031, por patentes que protegem composição, processo e uso. E o Wegovy, indicado para tratamento de obesidade e administrado na forma de injeção subcutânea semanal, só estará possivelmente livre para comercialização no período de 2038 a 2041, caso os dois últimos pedidos de patente sejam concedidos. Esses pedidos remanescentes reivindicam composição, uso, formulação aquosa, dispositivo e combinação de dose fixa. Enquanto não houver a expiração de todas essas patentes, a indústria nacional só poderá comercializar genérico para tratamento de diabetes tipo 2 e na forma de injeção subcutânea. Ou terá que encontrar novas rotas tecnológicas ou novos intermediários que diferenciem o produto do medicamento protegido.
Além da proteção patentária, ainda há diversos entraves que colocam o Brasil em uma posição fragilizada no mercado internacional. Custos altos para produção local, análises regulatórias demoradas, dependência da taxa de câmbio internacional, falta de incentivos fiscais e financeiros e extrema dependência externa de insumos dificultam a produção local e o fortalecimento do parque industrial brasileiro.
Na maioria dos casos, quando uma empresa concorrente não apresenta subsídios técnicos ao INPI, patentes de formulações ou dispositivos acabam sendo concedidas. Essa assimetria revela a fragilidade dos mecanismos institucionais voltados à análise crítica sob a ótica do interesse público. Ainda que iniciativas como a do Grupo de Apoio Jurídico (GAJ) da ABIFINA, que atua no âmbito judicial, e de entidades, como a própria ABIFINA, que atua no âmbito administrativo, venham contribuindo com pareceres técnicos relevantes, a ausência de uma atuação estatal direta e sistemática nesse campo permanece como uma lacuna importante no sistema nacional de Propriedade Intelectual.
Um desafio adicional é relacionado à implementação das Parceiras para o Desenvolvimento Produtivo (PDPs) e ao uso do insumo farmacêutico ativo (IFA) nacional. Frequentemente, observa-se que o IFA importado é utilizado durante a maior parte da Fase III da PDP, sendo o IFA nacional introduzido somente em fases finais de transferência tecnológica, quando há pouco tempo para amadurecimento da produção local. Em muitos casos, isso inviabiliza o retorno do investimento feito em território nacional, já que, ao final do ciclo da PDP, o fornecimento do medicamento entra em licitação pública, abrindo espaço para fornecedores estrangeiros.
Uma proposta debatida por especialistas do setor é garantir, independentemente da fase em que se encontra a PDP, um prazo mínimo de cinco anos para a aquisição do IFA nacional, o que daria previsibilidade e estímulo à consolidação da produção local.
Com o objetivo de fomentar a produção local e reduzir a dependência externa de insumos e de medicamentos, a ABIFINA elaborou um estudo com mais de 1.500 patentes de produtos farmacêuticos que irão expirar até 2030. Essas patentes formam blocos de proteção para mil produtos que estarão livres para produção e comercialização nesse período.
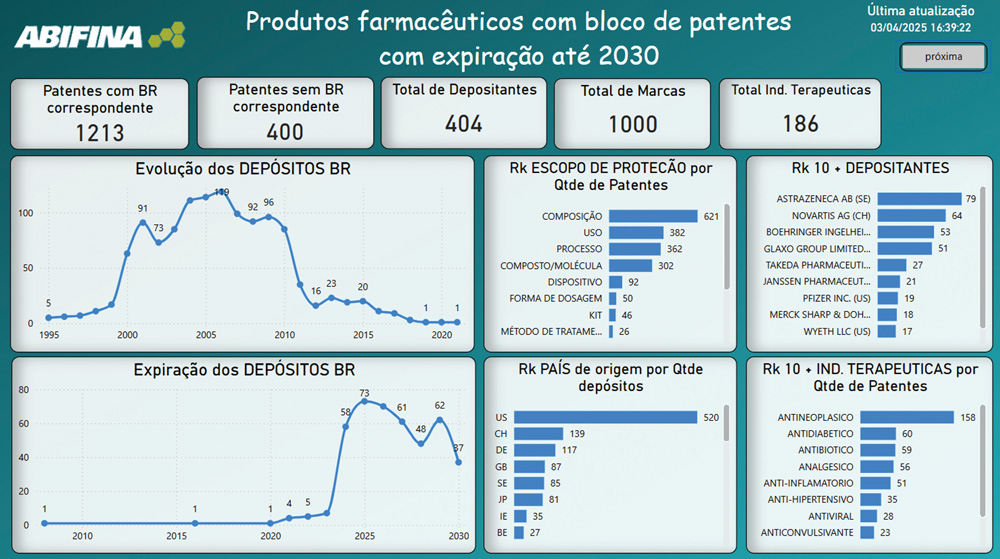
O escopo de proteção da maioria das patentes dos blocos se refere às composições farmacêuticas, mas também há patentes protegendo o uso da molécula ou da composição; processo produtivo de intermediários, ativos ou composições; molécula, sal, formas cristalinas, isômeros e estereoisômeros; dispositivos e partes de dispositivos, como injeções ou dispositivos de liberação nasal; forma de dosagem; kit de dosagem, kit de injeção; método de tratamento ou de prevenção (não aceitos no Brasil); embalagens em geral; e método de distribuição de fármacos.
Os principais depositantes são Astrazeneca, Novartis, Boehringer Ingelheim, Glaxo Group, Takeda Pharmaceutical Company, Janssen Pharmaceutical Company, Pfizer, Merck Sharp & Dohme, Wyeth e Bayer Intellectual Property. Os 10 maiores depositantes de patentes farmacêuticas no Brasil são EUA, seguidos da Suécia, Alemanha, Reino Unido, Suécia, Japão, Irlanda, Bélgica, Dinamarca e França.
No estudo, foram identificadas 186 indicações terapêuticas, sendo a maioria das patentes de produtos antineoplásicos. Nas demais indicações terapêuticas requeridas, é possível visualizar uma média de 50 a 60 patentes protegendo antidiabéticos, antibióticos, analgésicos e anti-inflamatórios.
O estudo da ABIFINA, portanto, não apenas mapeia oportunidades para a indústria e o governo conhecerem o que pode ser produzido e comercializado no Brasil e com um prazo máximo de cinco anos para lançamento. Com o conhecimento exato desse prazo, a indústria consegue identificar o que é passível de ser produzido em termos de insumos farmacêuticos ativos (IFAs) e de medicamentos, quais as exigências regulatórias que precisarão ser cumpridas e quais são os custos e riscos envolvidos.
Ainda que nem todos os produtos identificados representem, necessariamente, oportunidades imediatas para o SUS ou para PDPs, o mapeamento detalhado desses blocos de patentes é um insumo estratégico. Conhecê-los permite avaliar seu potencial de produção local, viabilidade econômica e alinhamento com as prioridades de saúde pública, contribuindo para escolhas mais assertivas em políticas industriais e tecnológicas.
O estudo da ABIFINA também escancara a necessidade urgente de aprimorar o modelo atual das PDPs. É preciso conscientizar empresas, formuladores de políticas públicas e a sociedade sobre a vulnerabilidade de um sistema produtivo fortemente dependente da importação de IFAs, sobretudo da Índia e da China. O Brasil carece de uma estratégia industrial robusta, com políticas de médio e longo prazo que assegurem soberania tecnológica e produtiva, em linha com os exemplos de verticalização produtiva observados em países como os Estados Unidos.
Com base nas informações levantadas, o governo tem em mãos uma ferramenta estratégica para orientar políticas públicas por missão, fomentar a produção local e ampliar o acesso da população a tratamentos de qualidade. Isso inclui, entre outras possibilidades, o direcionamento de PDPs, Avaliações de Tecnologias em Saúde (ATS), incorporações ao SUS e a promoção de alternativas terapêuticas para diversas doenças.




